에이치엘비 회장 "코빙턴도 '임상성공' 평가했었다…FDA 허가 신청"
탑라인 발표후 FDA Pre-NDA 신청, 24일 미팅 예정…FDA 신약허가 경향성 부합정희영 기자

진양곤 에이치엘비 회장이 29일 유튜브 채널을 통해 리보세라닙 글로벌 임상3상 탑라인 발표 후 미국 식품의약국(FDA) 허가 신청을 추진했던 배경을 설명했다.
진 회장은 "데이터 전체 결과를 기초로 한 내부 최종 의견과 다수의 신약허가 업무를 직접·수행한 미국 대형 로펌 '코빙턴'의 의견이 '임상성공'으로 일치했다"고 밝혔다.
회사는 지나달 FDA에 신약허가 사전미팅(Pre-NDA) 미팅신청을 완료하고 관련 자료를 제출했다. Pre-NDA 미팅은 다음달 24일로 예정됐다.
FDA 신약허가를 신청한 이유로 글로벌 임상3상 데이터를 꼽았다.
진 회장은 "데이터가 조금씩 확정되고 분석될 때마다 내부 전문가들 의견이 긍정적인 방향으로 극적인 변화를 보일 만큼 데이터가 좋았다"고 말했다.
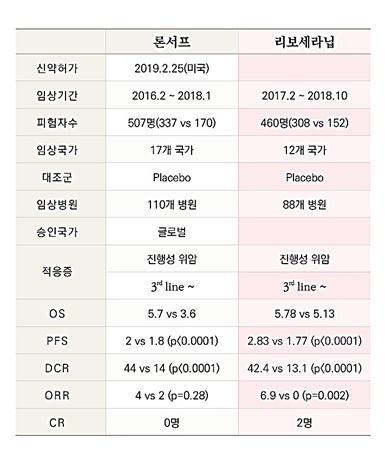
특히 임상 데이터에서 기존 약물대비 효능과 안전성이 높은 것으로 나왔다는 점을 강조했다.
진 회장은 "현재 위암 3차 치료제로 전세계에서 시판중인 약물은 론서프뿐이다"면서 "론서프와 비교해 리보세라닙은 월등히 높은 효능과 안전성을 보였다.
최근 FDA의 신약 허가 경향성을 보면 리보세라닙의 NDA 가능성이 높은 것으로 판단했다고 설명했다.
통계적 유의미성을 확보했지만 임상적 유의미성을 확보하지 못하면 FDA 허가가 어렵지만 통계적 유의미성을 확보하지 못했지만 임상적 유의미성을 확보했으면 가능성이 있다.
리보세라닙 글로벌 임상3상은 무진행생존기간(PFS), 객관적반응률(ORR), 질병 관리율(DCR), 낮은 부작용 등 임상적 유의미성을 확보했다.
진 회장은 "통계적 유미성은 확보하지 못했지만 임상적 유의미성을 확보한 경우 임상2상 결과, 안전성, 임상디자인 부적절성, 안전성 등의 조건을 감안해 허가 승인이 나게 되는데 리보세라닙은 모든 조건에 부합했다"고 설명했다.
회사는 이번 임상성공을 토대로 리보세라닙 신약허가에 집중한다는 계획이다.
진 회장은 "이번 결과를 바탕으로 글로벌 항암제를 시판하는 국내 최초의 기업이 되겠다는 목표를 내년 안에 실현하겠다"고 말했다.
정희영 머니투데이방송 MTN 기자

