[CEO리포트]곽병주 지엔티마마 대표 "올 상반기 Neu2000 중국 임상2상 결과 나온다"
국내 임상2상도 올해 말 완료, 기술이전 추진…내년 상반기 IPO 진행정희영 기자

[머니투데이방송 MTN 정희영 기자] 곽병주 지엔티파마 대표이사에게 2018년은 유독 중요한 해다. 올 상반기 뇌졸중 치료제 'Neu2000'의 중국 임상2상 결과를 시작으로 가시적인 성과들이 나오기 때문이다.
'뇌졸중이나 치매로 고통 받는 환자들에게 귀하게 쓰이는 약을 만들겠다'는 신념으로 20년 동안 뇌질환 치료제 연구개발에 매진한 곽 대표의 뚝심이 드디어 빛을 발하게 됐다.
◇'Neu2000' 중국 임상2상 가속도…환자 등록 빠르게 증가

최근 중국에서 진행 중인 Neu2000 임상2상은 임상환자 등록에 속도가 붙기 시작했다.
곽 대표는 "Neu2000의 안전성에 대한 임상 의사들의 신뢰가 쌓이면서 임상 등록 환자가 빠르게 늘어나고 있다"고 말했다.
지엔티파마가 개발 중인 Neu2000은 뇌졸중 치료를 위한 최초의 다중표적약물로 뇌세포 손상 유발물질인 글루타메이트와 활성산소의 독성을 동시에 막아준다.
Neu2000은 뇌졸중 동물모델에서 글루타메이트 흥분독성 NMDA 수용체 억제제나 활성산소 억제를 위한 항산화제를 단독 투여했을 때보다 뇌손상을 줄이는 약효가 탁월한 것으로 나타났다.
또한 미국에서 95명을 상대로 진행했던 임상 1상에서도 안전성이 입증됐다. 약효용량의 800배를 투여해도 심각한 부작용이 나타나지 않았다.
곽 대표는 "지난 25년 동안 250여개의 뇌졸중 치료제 임상이 진행됐지만 다 실패했다"면서 "그만큼 개발이 어려운 분야기 때문에 이번 임상2상의 의미가 크다"고 설명했다.
현재 중국에서 진행하고 있는 임상2상은 Neu2000의 약효와 안전성을 검증하기 위한 것으로, 발병 8시간 이내의 급성 허혈성 뇌졸중 환자 200명을 대상으로 진행한다.
곽 대표는 "현재 71명 환자에 대해 Neu2000 투약을 마쳤다"면서 "이 속도라면 올해 상반기에 임상2상을 완료하고 결과를 발표할 수 있을 것"이라고 말했다.
◇중국 뇌졸중 치료제 시장 진출 '청신호'…조기 상용화도 기대
 |
| 지엔티파마의 Neu2000의 중국 임상 2,3상이 중국 과학기술부 '중대신약창제'의 2017년 과학 및 기술 주요 프로젝트로 선정됐다. /제공=지엔티파마 |
최근 지엔티파마의 중국 진출에 대한 기대를 키우는 호재들도 쏟아지고 있다.
우선 회사는 중국 정부로부터 Neu2000의 중국 임상에 대한 연구비 지원을 받게 됐다.
지난해 12월 Neu2000 임상 2, 3상이 중국 정부의 '국가중장기과학과 기술발전계획강요(2006∼2020년)'의 과학기술 중대전문 프로젝트 중 하나인 '중대신약창제(重大新药创制)'의 2017년 과학 및 기술 주요 프로젝트로 선정된 것이다.
곽 대표는 "우리나라로 하면 대형 신약개발 정부 지원 과제에 선정된 것으로 2020년까지 중국 정부로부터 총 7551만 위안(약 130억 원)을 지원받게 됐다"고 말했다.
여기에 더해 이번 과제 선정으로 Neu2000의 중국 진출 시점도 앞당길 수 있게 됐다. 정부 과제로 선정된 신약에 대해 연구비 지원 외에 허가기간 단축 등 다양한 혜택을 제공하고 있기 때문이다.
곽 대표는 "보통 중국에서는 의약품 판매 승인 신청에서 실제 허가까지 1년 반이 걸린다"면서 그러나 "Neu2000은 정부 과제에 선정되면서 6개월 이내에 승인을 받을 수 있게 됐다"고 설명했다.
뿐만 아니라 Neu2000은 중국에서 판매 허가와 동시에 건강보험 급여도 적용된다.
곽 대표는 "건강보험 적용이 돼야 많은 환자들이 약을 쓸 수 있다"면서 "Neu2000의 정부 과제 선정은 사실 연구비 지원보다 건강보험 적용에 더 큰 의미가 있다"고 말했다.
◇올 하반기 국내 임상2상 완료…글로벌 제약사 관심 집중
 |
| 출처=지엔티파마 |
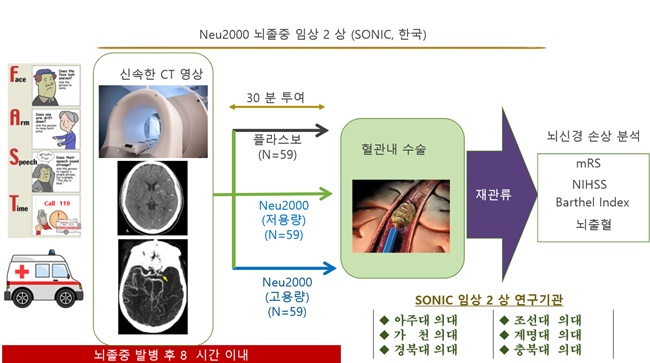
곽 대표는 국내에서 진행되고 있는 Neu2000의 국내 임상2상도 올해 말 완료될 것이라고 밝혔다.
국내 임상은 급성 허혈성 뇌졸중 환자 177명을 대상으로 진행하며 현재 임상을 완료한 환자는 61명이다.
곽 대표는 "초반에는 Neu2000의 국내 임상2상이 중국 임상보다 진행속도가 빨랐으나 연간 뇌졸중 발병환자 수 등의 차이로 중국 임상이 더 빨리 진행되고 있다"고 말했다.
중국의 연간 뇌졸중 발병환자수는 250만 명이다. 국내는 연간 18만 명을 중국의 14분의 1 수준이다.
또한 Neu2000의 국내 임상2상은 중국 임상과 다르게 설계됐다.
중국 임상2상은 뇌졸중 발병 8시간 이내의 허혈성 뇌졸중 환자를 대상으로 한다. 반면 국내 임상2상은 뇌졸중 발병 후 8시간 이내에 혈관 재개통 치료를 받은 환자가 대상이다.
그동안 뇌졸중 치료제 임상에서 지속적으로 제기됐던 동물실험과 임상연구의 연계성 부족이라는 한계를 극복한 것이다.
보통 동물실험에서는 쥐의 뇌혈관을 인위적으로 2시간 막은 후 다시 푼 상태에서 치료제를 투약한다. 그러나 실제 뇌졸중 발명 8시간 이내의 환자들 중에서는 뇌혈관이 막혀 있는 경우가 많다. 따라서 대부분의 동물실험에서는 뇌졸중치료제의 약효가 있는 것으로 나타나더라도 임상연구에서는 약효 검증에는 대부분 실패한다.
그러나 Neu2000의 국내 임상2상은 뇌졸중이 발병한 환자 중에서도 혈관내수술 환자를 대상으로 진행하기 때문에 Neu2000의 효능을 보다 정확히 검증할 수 있을 것으로 기대된다.
곽 대표는 "전 세계가 주목하고 있는 것은 국내 임상2상"이라면서 "혈전제거수술을 받은 뇌졸중 환자를 대상으로 임상을 진행하는 것은 세계 최초이기 때문"이라고 설명했다.
◇임상2상 완료 후 기술수출…내년 상반기 IPO 추진

지엔티파마는 Neu2000의 중국과 국내 임상2상 후 기술수출을 추진하고 있다.
회사는 현재 뇌졸중치료제가 없기 때문에 Neu2000 임상2상이 성공적으로 완료되면 글로벌 제약사들의 러브콜이 쏟아질 것으로 내다봤다.
곽 대표는 "많은 글로벌 제약사들이 Neu2000 관심을 보이고 있지만 임상2상 결과를 봐야지만 기술이전을 결정할 수 있다고 한다"고 설명했다.
그동안 전 세계적으로 250여 개 뇌졸중 치료제가 임상에서 줄줄이 실패할 정도로 뇌졸중 치료제는 연구개발이 어려운 분야인 만큼 글로벌 제약사들이 기술이전에 신중을 기하고 있는 것이다.
여기에 더해 회사는 Neu2000의 기술수출까지 완료하면 연구개발 성과를 바탕으로 기술특례 상장도 추진할 계획이다. 이미 2016년 KB증권을 상장주관사로 선정했다.
곽 대표는 "올해 Neu2000 국내 임상2상까지 완료하면 기술이전이 될 것이기 때문에 내년 상반기에는 기업공개(IPO)를 진행할 수 있을 것"이라고 말했다.
[머니투데이방송 MTN = 정희영 기자 (hee082@mtn.co.kr)]

