올릭스 "비대흉터치료제 미국 FDA 임상2상 IND 신청"
이대호 기자
올릭스가 미국에서 비대흉터 치료제 임상 2상을 위한 IND(임상시험계획)를 신청했다.
올릭스는 비대흉터 치료 신약프로그램 'OLX101A(물질명 OLX10010)'의 미국 임상 2상 진행을 위한 IND 승인 신청을 완료했다고 25일 밝혔다.
올릭스는 3세대 신약개발 플랫폼인 'RNA 간섭' 기술을 바탕으로 다양한 난치성 질환에 대한 치료제를 개발하는 혁신신약 기업이다.
비대흉터는 외과적 수술이나 외상 후 상처 부위가 회복되는 과정에서 진피층의 콜라겐이 과다하게 증식해 결정 형태로 튀어나오면서 비정상적인 흉터가 생기는 증상을 말한다.
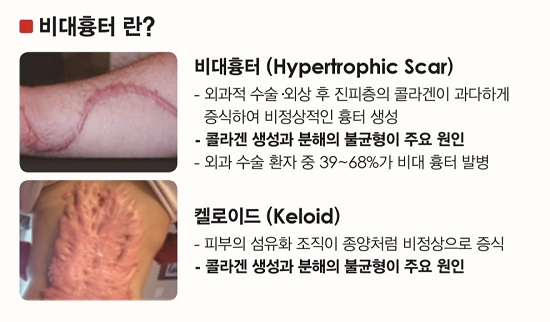 |
| 비대흉터 증상과 원인 / 이미지=올릭스. |
비대흉터는 외과적 수술이나 외상 후 상처 부위가 회복되는 과정에서 진피층의 콜라겐이 과다하게 증식해 결정 형태로 튀어나오면서 비정상적인 흉터가 생기는 증상을 말한다.
통증을 동반할 뿐만 아니라 심할 경우 자신감 상실 및 대인기피 등의 문제를 야기할 수 있어 반드시 치료가 필요한 질환으로 꼽힌다. 정도는 다르지만, 외과 수술을 받은 환자의 약 40% 이상이 비대흉터 발병을 경험할 정도로 흔하게 발생하는 질환이다.
기존 비대흉터 치료법은 스테로이드성 주사 및 연고, 레이저 치료술, 외과적 수술법 등이 있지만, 아직 비대흉터 치료제로 승인받은 전문의약품은 없는 상태다.
따라서 흉터의 생성 기전에 직접적으로 관여해 흉터 생성을 억제하는 치료제가 개발될 경우, 기존 치료법과의 경쟁에서 수월하게 우위를 점할 수 있을 것이라는 전망이다.
앞서 올릭스는 휴젤에 OLX101A에 대한 아시아 판권을 이전했고, 현재 휴젤이 국내 임상 2상을 진행하고 있다.
아시아 지역 이외 글로벌 마켓에 대한 권리는 올릭스가 보유하고 있다. 올릭스는 비대흉터와 켈로이드 치료제의 글로벌 시장 규모를 2020년 기준 약 63억 달러(약 7조 4,000억원)에 달하는 것으로 추산하고 있다.
올릭스는 지난 2018년 OLX101A 프로그램에 대해 자체적으로 영국에서 임상 1상 시험을 진행해 신약후보물질의 안전성을 확인한 바 있다.
이번 미국 임상2상 신청이 FDA에서 승인되면 미국 내 5개 시험 기관에서 비대흉터 환자 20~30명을 대상으로 임상시험을 진행할 예정이다. 이를 통해 OLX101A의 유효성과 안전성을 확인할 계획이다.
이동기 올릭스 대표이사는 "이번에 신청하는 미국 임상2상 시험을 통해 OLX101A의 흉터 치료 효능을 입증하게 되면 글로벌 혁신신약(first-in-class) 비대흉터 치료제 자리에 한 발짝 더 다가가게 될 것으로 기대한다."며, "본 프로그램에 대해 관심을 표명한 다국적 제약사들과의 기술이전 협상에도 긍정적으로 작용할 것으로 예상한다."고 말했다.
이대호 머니투데이방송 MTN 기자

