[단독] SD바이오센서도 FDA 긴급사용승인 신청 요청 받았다…"신청 진행중"
PCR·항체 진단키트 2개 제품…"지난달 28일, 12일 식약서 수출 허가 승인"정희영 기자
SD바이오센서도 미국 식품의약국(FDA)로부터 코로나19 진단키트 긴급사용승인신청 요청을 받은 것으로 확인됐다.
20일 SD바이오센서 관계자는 "FDA로부터 요청을 받아 현재 FDA에 긴급사용승인 신청을 진행하고 있다"고 밝혔다.
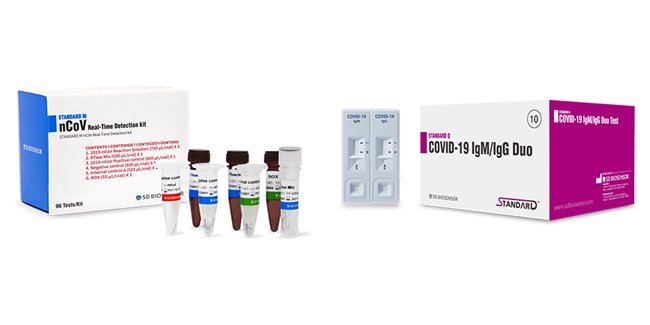
FDA에 긴급사용승인을 신청할 제품은 '스탠다드M 코로나19 신속진단키트(STANDARD M n-CoV Real-Time Detection Kit)'와 '스탠다드Q 코로나19 진단키트(STANDARD Q COVID-19 IgM/IgG)'다.
스탠다드M 코로나19 신속진단키트는 식약처 긴급사용승인을 받은 제품으로 유전자(E gene, RdRp gene)를 기반으로 검사하는 체외진단용 의료기기다. 스탠다드Q 코로나19 진단키트는 소량의 혈액으로 코로나19 바이러스 항체(IgM, IgG)를 기반으로 코로나19 감염 여부를 10분 이내에 측정할 수 있다.
회사 관계자는 "스탠다드M과 스탠다드Q는 각각 2월 28일과 3월 12일 식약처로부터 수출용 허가를 받았다"고 말했다.
이미 이 제품들은 해외 수출이 진행되고 있다. 회사 측은 스탠다드M 코로나19 신속진단키트와 스탠다드Q 코로나19 진단키트를 동남아, 유럽, 중남미 전역에 수출하고 있다고 설명했다.
FDA는 최근 코로나19 진단키트에 대해 잇따라 긴급사용 승인을 내주고 있다. 미국 내 코로나19 확진자가 급증하면서 진단능력 부족이 도마 위에 올랐기 때문이다.
세계보건기구(WHO)가 18일(현지시간) 발표한 코로나19 상황보고서에 따르면 미국의 코로나19 확진자는 3,536명으로 일주일 전인 11일 696명이었던 것과 비교하면 5배 증가했다. 사망자도 25명에서 58명으로 2배 늘었다.
지난 13일 처음으로 스위스 로슈의 코로나19 진단키트를 긴급사용승인한데 이어 미국의 서모피셔 사이언티픽, 애보트 연구소(ABT) 제품도 있다라 승인했다.
국내에서도 SD바이오센서를 비롯해 코젠바이오텍, 솔젠트, 랩지노믹스 등이 FDA로부터 긴급사용승인을 신청해 달라는 요청을 받고 현재 관련 자료 등을 준비를 하고 있다.
정희영 머니투데이방송 MTN 기자

