지엔티파마 '넬로넴다즈', 복지부 신약개발 신규과제 최종 선정
미 FDA에 희귀질환 의약품 지정 신청서 제출…"전 세계 심성지 환자 치료제 출시 목표"정희영 기자

신약개발 벤처기업인 지엔티파마는 자사가 심정지 환자의 치료제로 개발하고 있는 뇌세포 보호 신약 '넬로넴다즈'가 보건복지부에서 주관하는 '2020년도 제1차 보건의료 R&D 신규지원 대상과제'의 신약개발임상시험 지원과제로 최종 선정돼 연구협약식을 체결했다고 29일 밝혔다.
회사는 이번 희귀질환 신약개발임상시험 과제 선정으로 보건복지부로부터 현재 진행중인 심정지 환자에 대한 임상2상 시험 연구비를 지원받게 된다.
넬로넴다즈는 뇌세포 손상의 주원인인 글루타메이트 신경독성과 활성산소 독성을 동시에 제어하는 다중표적약물로 알려져 있다. 선정된 심정지 임상2상 시험은 병원 밖에서 인공 소생에 성공해 저체온 치료를 받는 150명의 심정지 환자를 대상으로 4시간 이내에 넬로넴다즈(세계보건기구의 국제일반명)를 정맥투여했을 때 약물의 안전성과 뇌손상 방지 약효를 검증하는 것을 목표로 한다.
주관연구기관은 삼성서울병원이며, 전남대병원 등 5개 대학병원 응급의학과에서 임상연구에 참여하고 있다. 이번 임사은 뇌손상바이오마커, 뇌 MRI 영상 및 행동기능 등을 분석해 약효를 검증하는 연구로 현재까지 54명의 환자에 대한 임상시험을 진행했다.
넬로넴다즈는 지난해 12월에 식품의약품안전처로부터 개발단계 희귀의약품으로 지정받았고, 최근에 미국 식품의약국(FDA)에 희귀질환 의약품 지정 신청서를 제출했다.
현재 희귀질환의 수는 1만개가 넘는데 희귀질환 의약품으로 지정되면 임상연구, 의약품 신속심사, 독점권, 세제혜택 등 많은 지원을 받기 때문에 미국 FDA에서 승인되는 희귀질환 신약의 수는 계속 증가하는 추세다.
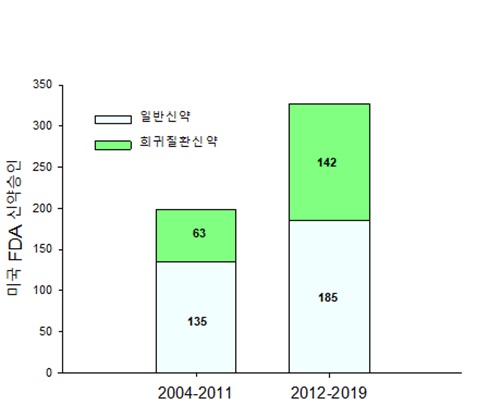 |
| 미국 식품의약국(FDA)의 희귀의약품 승인 현황. /제공=지엔티파마 |
실제로 2004~2011년 동안 승인된 희귀질환 의약품 신약의 수는 63개에서 2012~2019에는 142개로 125% 증가했는데, 동일기간 일반의약품 신약은 37% 증가했다.
곽병주 지엔티파마 대표(연세대학교 생명과학부 겸임교수)는 "넬로넴다즈는 혈관 재개통 후에 나타나는 뇌손상을 방지하는 효과가 탁월하기 때문에 자가순환이 재개된 심정지 환자에서 장애와 사망의 주 원인인 뇌손상을 막을 것으로 기대된다"고 밝혔다.
이어 "이번에 보건복지부의 희귀질환 신약개발 지원을 받았고 미국 FDA에도 희귀질환의약품 지정 신청을 완료했기 때문에 심정지 임상2상을 성공적으로 완료해 전 세계 심정지 환자 치료제로 출시 할 수 있도록 최대한 지원할 것"이라고 덧붙였다.
정희영 머니투데이방송 MTN 기자

